Projekt LIDER


Celem Programu LIDER jest poszerzenie kompetencji młodych naukowców w samodzielnym planowaniu, zarządzaniu oraz kierowaniu własnym zespołem badawczym, podczas realizacji projektów posiadających możliwość wdrożenia w gospodarce.
Informacja o projekcie
Tytuł projektu: Mikrosystem Lab-on-a-chip do modelowania i badania wzrostu komórek mięśnia sercowego. (Microsystem Lab-on-a-chip for biomimic and growth analysis of cardiac cells.)
No. LIDER/026/573/L-4/12/NCBR/2013
Okres realizacji: 1.01.2014 – 31.12.2017
Zespół badawczy realizujący projekt:
• Dr inż. Elżbieta Jastrzębska - KIEROWNIK PROJEKTU

• Dr inż. Iwona Lasocka (Jesion)
• Dr inż. Kamil Żukowski
• Dr inż. Ilona Grabowska-Jadach
• Mgr inż. Ewelina Tomecka
• Mgr inż. Anna Kobuszewska
• Mgr inż. Patrycja Sokołowska
• Mgr inż. Paweł Ćwik
Cel projektu
Celem projektu jest opracowanie i wykonanie nowego mikrosystemu wykorzystywanego do hodowli i modelowania wzrostu komórek mięśnia sercowego. Głównym zadaniem jest opracowanie geometrii mikroukładu w ten sposób, aby warunki prowadzenia hodowli komórek były jak najbardziej zbliżone do warunków in vivo. Ponadto, planowane jest wytworzenie odpowiednich rusztowań w mikrokanałach układu, umożliwiających przestrzenne ułożenie i wzrost komórek mięśnia sercowego. W tym celu wykorzystane zostaną biomateriały, stosowane w klasycznej inżynierii tkankowej (np. hydrożele). Opracowany mikroukład zakłada integrację/połączenie z elektrodami wykorzystywanymi do stymulacji komórek za pomocą pola elektrycznego.
Projekt mikrosystemu zakłada wykonanie w jednym mikroukładzie:
- miejsca wzrostu hodowanych komórek, zmodyfikowanego materiałami pozwalającymi na ich przestrzenne ułożenie;
- sieci mikrokanałów umożliwiających stworzenie systemu dozowania medium hodowlanego oraz innych reagentów wykorzystywanych do analizy funkcji komórek;
- systemu połączenia elektrod, stosowanych do stymulacji komórek macierzystych.
Opracowany i wykonany system typu Lab-on-a-chip zostanie sprawdzony pod kątem możliwości zastosowania go do hodowli i badania kardiomiocytów oraz komórek macierzystych. Zastosowane komórki (uzyskane z komercyjnych banków komórek np. ATCC) stanowić będą model badawczy.
Mikroukład posłużyć może do przyspieszenia badań dotyczących określenia właściwości terapeutycznych związków stosowanych w chorobach serca. Celem pracy jest wytworzenie mikroukładu, który w przyszłości stanowiłoby narzędzie możliwe do zastosowania w laboratoriach biologicznych, farmaceutycznych i medycznych.
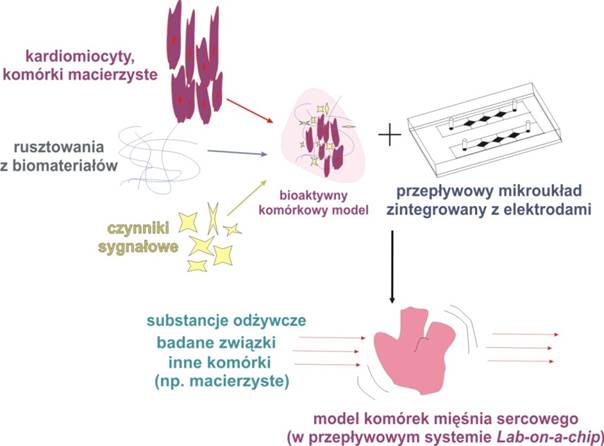
Rys. 1 Koncepcja przeprowadzonych badań.
Zadania badawcze:
Zadanie 1 Opracowanie koncepcji mikroukładu do hodowli i modelowania wzrostu komórek mięśnia sercowego.
Zadanie 2 Wykonanie serii zaprojektowanych mikroukładów w poli(dimetylosiloksanie).
Zadanie 3 Wytworzenie przestrzennych struktur wewnątrz mikroukładu do hodowli komórek mięśnia sercowego.
Zadanie 4 Optymalizacja warunków wzrostu komórek mięśnia sercowego w mikroukładzie
Zadanie 5 Opracowanie metody badania wzrostu komórek mięśnia sercowego w mikroukładzie po stymulacji bodźcami zewnętrznymi.
Zadanie 6 Opracowanie instrukcji dla „końcowego użytkownika” oraz wskazanie obszarów wykorzystania opracowanego mikroukładu do hodowli komórek mięśnia sercowego.
Realizacja zadań badawczych projektu:
Opracowano kilka geometrii mikroukładów do prowadzenia w nich dwu- (2D) oraz trójwymiarowej (3D) hodowli komórek. Do zaprojektowania mikrostruktur układu wykorzystano programy AutoCAD oraz SolidWorks. Przeprowadzono badania związane z przepływem płynów w zaprojektowanych mikrostrukturach (m.in. z wykorzystaniem programu COMSOL Multiphysics). Do wytworzenia zaprojektowanych mikrostruktur wykorzystano technikę mikrofrezowania oraz odlewu. W ramach badań wyselekcjonowano dwa główne mikroukłady, które stanowić mogą innowacyjne narzędzia służące jako modele badawcze w ocenie wzrostu komórek serca i komórek macierzystych oraz opracowano mikrodozownik do wprowadzania badanych związków.
· Mikrosystem PDMS/szkło z mikrosłupkami
Mikrostruktury wykonane w poli(dimetylo siloksanie) (PDMS) zawierały mikrokanał główny podzielony za pomocą mikrosłupków na trzy mniejsze mikrokanały. Mikrosłupki miały na celu oddzielenie wprowadzanego hydrożelu od medium hodowlanego. Wymiary mikrostruktur: główny mikrokanał - 2 mm x 900 µm, mikrosłupki - 100 µm x 120 µm, odległość pomiędzy 50 µm. Wysokość mikrokanałów 200 µm. Mikroukład ten możliwy jest do zintegrowania z elektrodami złotymi, które umieszczane są w bocznych mikrokanałach układu. Do uzyskania hodowli przestrzennej w tego typie mikroukładu zastosowano hydrożel PuraMatrix.
(zgłoszenie patentowe nr P.412087, 22-04-2015)
· Mikrosystem PDMS/PDMS z nanowłóknami poliuretanowymi (PU)
Geometrię mikroukładu stanowił prosty kanał (długość kanału- 1cm, szerokość i wysokość – 1mm). Pomiędzy dwoma warstwami PDMS, na wysokości kanału umieszczono fragment maty nanowłóknistej - nanowłókna poliuretanowe (PU) zmodyfikowane fibronektyną, które posłużyły do hodowli 3D.
(Nanomateriały uzyskano w ramach współpracy z grupą prof. Tomasza Ciacha z Wydziału Inżynierii Chemicznej i Procesowej Politechniki Warszawskiej).
· Automatyczny mikrodozownik - w celu większej automatyzacji badań opracowano automatyczny mikrodozownik, umożliwiający w zautomatyzowany i zdalnie sterowany sposób doprowadzanie medium hodowlanego i badanych roztworów do badanych komórek umieszczonych w mikroukładach
(zgłoszenie patentowe nr P.424410, 29.01.2018)
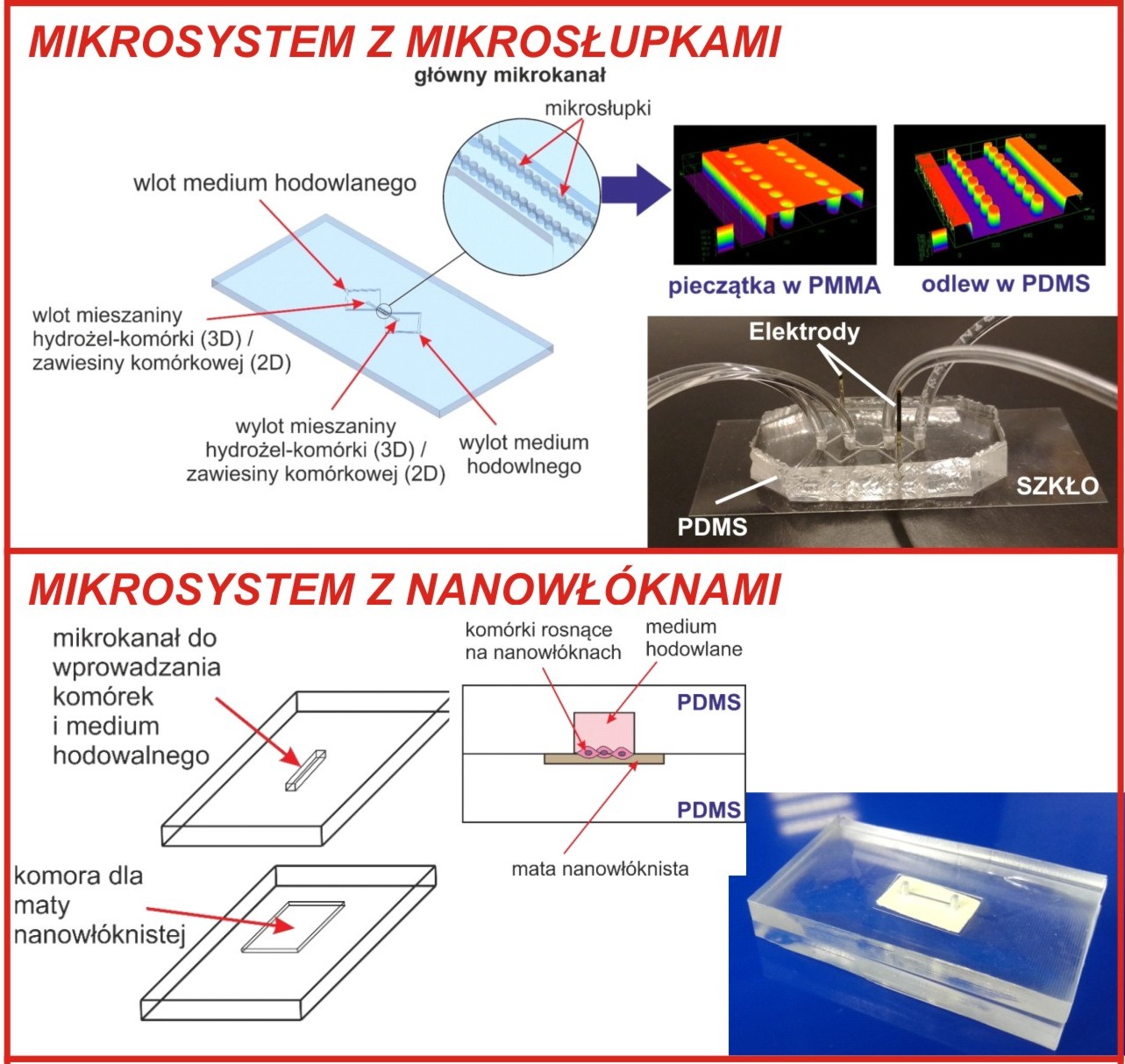
Rys. 2
Hodowla w mikroukładach:
W opracowanych mikroukładach przeprowadzoną hodowlę dwu- (2D) oraz trójwymiarową (3D) komórek:
· H9C2 – szczurze kardiomioblasty
· HCM – ludzkie kardiomiocyty
· hMSC – ludzkie mezynchemalne komórki macierzyste
W celu założenia hodowli komórek w mikroukładzie z nanowłóknami zawiesina komórek wprowadzana była bezpośrednio otworem wlotowym. Procedura enkapsulacji komórek w hydrożelu (3D) i wprowadzania zawiesiny komórkowej (2D) do mikroukładu z mikrosłupkami składała się z dwóch etapów. W pierwszym etapie w przypadku hodowli 3D płynna mieszanina hydrożelu (PuraMatrix) i komórek oraz medium hodowlane wprowadzano do mikroukładu jednocześnie. W drugim etapie, w momencie kiedy mieszanina wypełniła przestrzeń pomiędzy mikrosłupkami na całej długości głównego mikrokanału przepływy obu roztworów zostały wyłączone. Wyniku kontaktu medium hodowlanego z płynną mieszaniną hydrożelu i komórek (w przestrzeniach pomiędzy mikrosłupkami) i w wyniku dyfuzji medium do wnętrza mieszaniny, hydrożel ulega żelowaniu a komórki enkapsulacji w jego wnętrzu. W przypadku hodowli 2D oba roztwory: zawiesina komórkowa i medium hodowlane były wprowadzane do mikroukładu jednocześnie. W momencie kiedy zawiesina komórkowa wypełniła przestrzeń pomiędzy mikrosłupkami na całej długości głównego mikrokanału przepływy obu roztworów zostały wyłączone (Rys. 3)
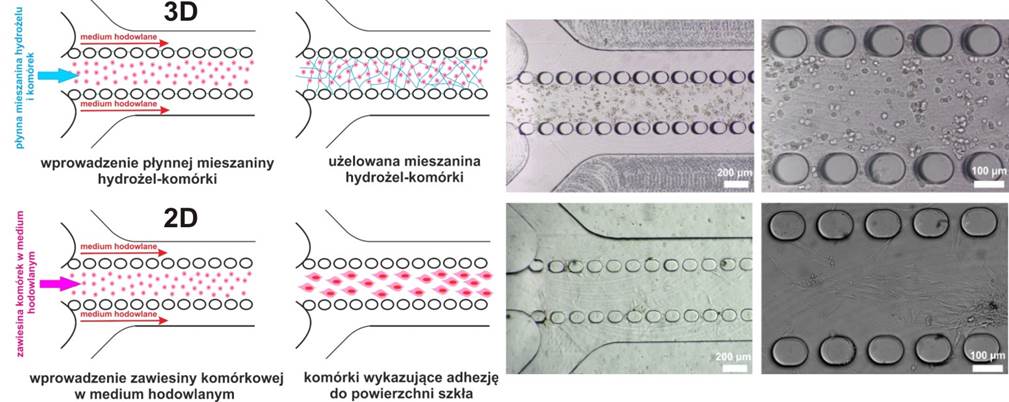
Rys. 3
Metody oceny stanu hodowli w mikroukładach:
Opracowano metody obserwacji i oceny wzrostu komórek (mikroskopia konfokalna i fluorescencyjna oraz pomiary spetrofluorymetryczne), m.in.:
· Test Alamar Blue
· Test barwienia różnicowego kalceiną-AM i jodkiem propidyny
· Barwienie barwnikiem JC-1
· Immunobarwienie (α-aktynina sarkomerowa, tropiona T)
Analiza proliferacji, testy w mikroukładach
W opracowanych mikroukładach zbadano wzrost komórek hodowanych w w postaci monowarstwy (2D) oraz ułożenia przestrzennego (3D) dla zoptymalizowanych warunków. Przestrzenną hodowlę w mikroukładzie ludzkich kardiomiocytów (HCM) prowadzono w hydrożelu PuraMatrix, natomiast komórek H9C2 na nanowłóknach poliuteranowych (PU) modyfikowanych fibronektyną (Rys.4).
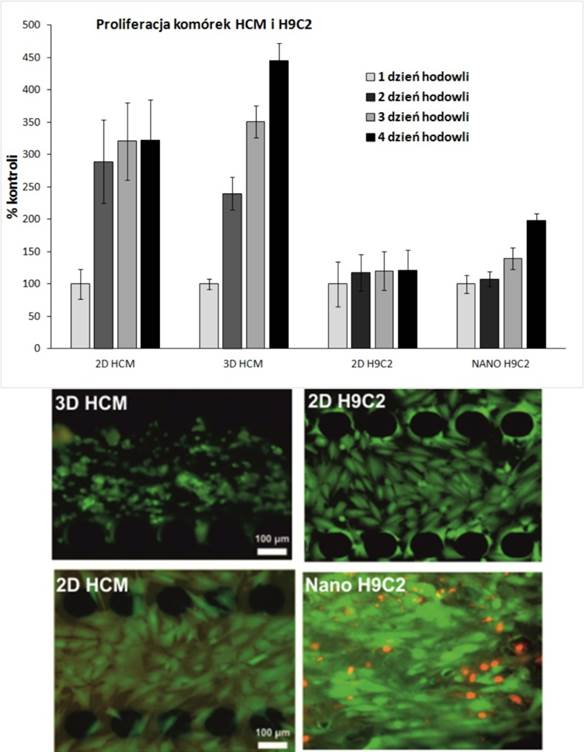
Rys. 4
W opracowanych mikroukładach testowano wpływ różnych czynników na komórki HCM, H9C2 i hMSC hodowane w postaci 2D lub 3D. Zbadano między innymi działanie takich czynników jak:
· związek potencjalnie wykazujący działanie terapeutyczne w chorobach serca (izoprotenerol)
· związek cytotoksyczny (5-fluorouracyl, 5-FU)
· związek symulujący niedotlenienie w komórkach (m-trifluorometoksyfenylohydrazon cyjanek karbonylu, FCCP)
· czynniki różnicujące (5-azacytydyna, 5-AZA; czynnik wzrostu śródbłonka naczyniowego, VEGF; stymulacja polem elektrycznym, 10v/cm, 1Hz, 1ms przez 7d).
Ponadto, monitorowano czy działanie powyższych czynników wpływa na zmianę takich parametrów jak np. poziom wewnątrzkomórkowych jonów wapnia Ca2+, poziom reaktywnych form tlenu – ROS. Takie same badania porównawczo prowadzone były w makroskali za pomocą klasycznych metod hodowli na płytkach wielodołkowych. Na podstawie przeprowadzonych badań oceniano wzrost komórek i tempo ich proliferacji. Dla obydwu linii komórkowych zaobserwowano inną odpowiedź komórek na działanie czynników zewnętrznych w hodowli 2D i 3D (Rys.5).
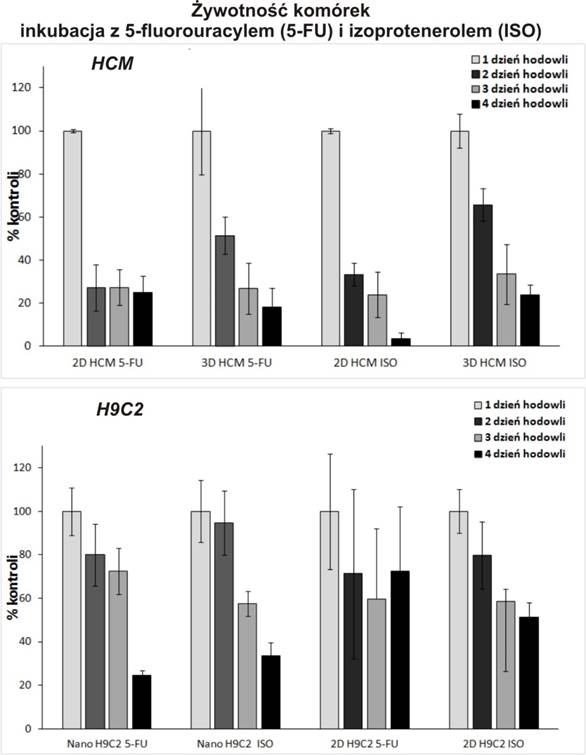
Rys. 5
Ekspresję markerów sercowych (α-aktyninę sarkomerową, troponię T) w komórkach hMSC badano po 7 dniach stymulacji. Zaobserwowano, że dobrane parametry różnicowania nie wpływają negatywnie na żywotność komórek hMSC hodowanych przez 7 dni w opracowanym mikroukładzie. Ponadto, zaobserwowano wzrost ekspresji wybranych markerów sercowych. Wykazano, że najwyższy poziom różnicowania osiągany był dla komórek stymulowanym polem elektrycznym oraz komórek inkubowanych z 5-AZA (Rys. 6). Ponadto, zaobserwowano szybszy wzrost ekspresji badanych markerów w porównaniu z badaniami przeprowadzonymi makroskali.
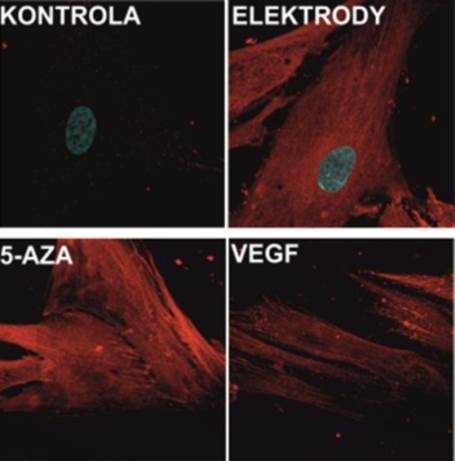
Rys. 6
Na podstawie przeprowadzonych badań oceniono działanie powyższych czynników i potwierdzono, że opracowany mikrosystem z mikrosłupkami i jak również z nanowłóknami jest dobrym modelem badawczym z powodzeniem wykorzystywanym do naśladowania wzrostu komórek mięśnia sercowego i oceny toksycznego działania różnych związków jak również do prowadzenia różnicowania komórek macierzystych w kierunku kardiomiocytów.
Efektem końcowym niniejszego projektu jest opracowany demonstrator przygotowany do wprowadzania i hodowli (2D lub 3D) wybranych komórek mięśnia sercowego lub komórek macierzystych. Dodatkowo, mikroukłady te zintegrowane mogą być ze specjalnie opracowanym mikrodozownikiem, ułatwiającym i umożliwiającym zautomatyzowaną manipulację prowadzonej hodowli. Zoptymalizowana została metoda tworzenia zaprojektowanych mikrowzorów w PDMS. Ponadto, dobrano warunki wytwarzania przestrzennych struktur wewnątrz mikrokanałów oraz sposób połączenia mikroukładu z elektrodami. Efekt końcowym są również raporty i protokoły opisujące metodę wprowadzenia komórek mięśnia sercowego i prowadzenia ich hodowli w mikroukładzie.
Publikacje powstałe w ramach projektu
1. „Research on the use of hydrogel for the three-dimensional cell culture in microfluidic system”, E. Tomecka, E. Jastrzębska, M. Chudy, A. Dybko, Proceedings of SPIE, 9291, 92910K-1-92910K-7, 2014
2. “Recognition and distinction of MCF-7 DOX and MCF-7 WT cells using impedance spectroscopy”, E. Jastrzębska, R. Meissner, P. Renaud, Z. Brzózka, Proceedings of 18th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2014, 564-566
3. “Heart-on-a-chip based on stem cell biology”, E. Jastrzębska, E. Tomecka, I. Jesion, Biosensors Bioelectronics, 75, 67-81, 2016
4. “Analysis of the efficiency of photodynamic therapy using a microsystem for mono-, co- and mixed cultures.” E. Jastrzębska, M. Bulka, N. Rybicka, K. Zukowski, Sensors and Actuators B-Chemical, 221, 1356-1365, 2015
5. “Proliferation of cardiac cells cultured under static and perfusion conditions” E. Jastrzębska, A. Kobuszewska, E. Tomecka, P. Renaud, Z. Brzózka, Proceedings of 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2015, 636-638
6. “Cardiac cell culture in microfluidic system with micropillar array” E. Tomecka, A. Kobuszewska, K. Żukowski, E. Jastrzębska, M. Chudy, A. Dybko, Z. Brzózka, Proceedings of 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2015, 639-641
7. “Poly(l-lactic acid) and polyurethane nanofibers fabricated by solution blow spinning as potential substrates for cardiac cell culture” E. Tomecka, M. Wojasinski, E. Jastrzebska, M. Chudy, T. Ciach, Z. Brzozka, Materials Science and Engineering: C, 2017, 75, 305-316
8. "Heart-on-a-Chip - studies on cardiac (H9C2) cell proliferation using impedance spectroscopy" A. Kobuszewska, P. Cwik, E. Jastrzębska, P. Renaud, Z. Brzózka, Proceedings of 20th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2016, 523-524
9. “Heart-on-a-Chip: An Investigation of the Influence of Static and Perfusion Conditions on Cardiac (H9C2) Cell Proliferation, Morphology, and Alignment”, A. Kobuszewska, E. Tomecka, K. Żukowski, E. Jastrzębska, M. Chudy, A. Dybko, P. Renaud, Z. Brzózka, SLAS Technology, 22, 2017, 536-546
10. “Microsystem with micropillar array for three- (gel-embedded) and two-dimensional cardiac cell culture”, E. Tomecka ,K. Zukowski, E. Jastrzebska, M. Chudy, A. Dybko, Z. Brzozka, Sensors and Actuators B-Chemical , 2018, 254, 973-983
11. “Microfluidic system for monitoring of cardiac (H9C2) cell proliferation”, A. Kobuszewska, P. Cwik, E. Jastrzębska (Jędrych), Z. Brzozka, M. Chudy, P. Renaud, A. Dybko, Proceedings of SPIE - The International Society for Optical Engineering, 2017, 10247, 102470E-1-102470E-6
12. “Cell model of myocardial hypoxia in lab-on-a-chip system” A. Kobuszewska, E. Jastrzębska, M. Chudy, A. Dybko, Z. Brzózka, Proc. of 21th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2017, 1165-1166
13. “Microfluidic heart model for drug cytotoxicity analysis” E.Tomecka, K. Zukowski, E. Jastrzębska, M. Chudy, Z. Brzózka, Proc. of 21th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2017, 816-817
14. Książka – “Cardiac Cell Culture Technologies Microfluidic and On-chip systems” ed. E. Jastrzębska, Z. Brzózka, SPRINGER ISBN 978-3-319-70684-9, 2018
a) Rozdział: “Introduction” E. Jastrzębska, Z. Brzózka, 1-2 w “Cardiac Cell Culture Technologies Microfluidic and On-chip systems” ed. E. Jastrzębska, Z. Brzózka, SPRINGER ISBN 978-3-319-70684-9, 2018
b) Rozdział: “Microfluidic systems for cardiac cell culture-characterization”, E. Jastrzębska, Z. Brzózka, 155-168 w “Cardiac Cell Culture Technologies Microfluidic and On-chip systems” ed. E. Jastrzębska, Z. Brzózka, SPRINGER ISBN 978-3-319-70684-9, 2018
c) Rozdział: “Heart-on-a-chip Systems”, M. Bułka, E. Jastrzębska, 169-200 w “Cardiac Cell Culture Technologies Microfluidic and On-chip systems” ed. E. Jastrzębska, Z. Brzózka, SPRINGER ISBN 978-3-319-70684-9, 2018
d) Rozdział: “Cardiac Cell Culture Microtechnologies Based on Stem Cell” A. Kobuszewska, P. Sokołowska, E. Jastrzębska 201-231 w “Cardiac Cell Culture Technologies Microfluidic and On-chip systems” ed. E. Jastrzębska, Z. Brzózka, SPRINGER ISBN 978-3-319-70684-9, 2018
Zgłoszenia patentowe, patenty:
1. „Przepływowy mikrosystem do hodowli komórek, zwłaszcza komórek sercowych”, E. Jastrzębska, E. Tomecka, K. Żukowski, zgłoszenie patentowe: P.412087, 22-04-2015
2. „Kardridż mikrodozownika do badania skuteczności terapii w warunkach przepływowych”, K. Żukowski, E. Jastrzębska, M. Chudy, A. Dybko, Z. Brzózka P.424410, 29.01.2018
Udział w konferencjach krajowych i międzynarodowych:
1. “Development of a microfluidic system for hydrogel-based three-dimensional cell culture”, E. Tomecka, E. Jastrzębska, K. Żukowski, M. Chudy, A. Dybko, Z.Brzózka, 3rd Annual Conference & Exhibition SLAS 2014, USA/ San Diego, 18-22.01.2014
2. “Research on the development of a microfluidic system for hydrogel-based three-dimensional cell culture”, E. Tomecka, E. Jastrzębska, M. Chudy, Z.Brzózka, International Conference associated with official Opening Ceremony of Malopolska center of Biotechnology Jagiellonian University "Challenges of Biotechnology in 21st Century 2014", Kraków, 13-14.05.2014
3. „Badania nad opracowaniem mikrosystemu przepływowego do przestrzennej, hodowli komórek z wykorzystaniem hydrożelu”, E. Tomecka, E. Jastrzębska, XI Warszawskie Seminarium Doktorantów Chemików- Chemsession'14, Warszawa, 16.05.2014
4. “Research on the use of hydrogel for the three-dimensional cell culture in microfluidic system”, E. Tomecka, E. Jastrzębska, M. Chudy, A.Dybko, XIII Międzynarodowa Konferencja Naukowa COE 2014 Czujniki Optyczne i Elektroniczne, Łódź, 22-25.06.2014
5. “Design of microfluidic system for three-dimensional cardiac cell culture”, E. Tomecka, K. Żukowski, E. Jastrzębska, 9th international Conference Young Scientist Towards The Challenges of Modern Technology 2014, Warszawa, 22-24.09.2014
6. “Recognition and distinction of MCF-7 DOX and MCF-7 WT cells using impedance spectroscopy”, E. Jastrzębska, R. Meissner, P. Renaud, Z. Brzózka, 18th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2014, San Antonio, USA, 26-30.10.2014
7. “Microfluidic systems for carcinoma and cardiomyocyte cells culture”, E. Tomecka, K. Żukowski, E. Jastrzębska, Z. Brzózka, Nano Bio Tech 2014, Montreux, Szwajcaria, 17-19.11.2014
15. “Development of a Microfluidic System for Three-dimensional Cardiac Cell Culture”, E. Tomecka, E. Jastrzębska, K. Żukowski, M.Chudy, A. Dybko A., Z. Brzózka, 4rd Annual Conference & Exhibition SLAS 2015, 7-11.02.2015
16. “Badania proliferacji komórek mięśnia sercowego na nanowłóknach polimerowych”, E. Tomecka, M. Wojasiński, E. Jastrzębska, M. Chudy, T. Ciach, XII Warszawskie Seminarium Doktorantów Chemików-ChemSession’15, 08.05.2015
17. „Hodowla komórek mięśnia sercowego w systemach typu Lab-on-a-chip w warunkach przepływowych”, Hodowla komórek mięśnia sercowego w systemach typu Lab-on-a-chip w warunkach przepływowych, XII Warszawskie Seminarium Doktorantów Chemików-ChemSession’15, 08.05.2015
18. „Badanie proliferacji komórek mięśnia sercowego w mikrosystemach przepływowych”, A. Kobuszewska, E. Tomecka, E. Jastrzębska, I Ogólnopolska Konferencja Młodych Naukowców „Azymut 2015”, 17.06.2015
19. „Badania nad wykorzystaniem nanowłókien polimerowych jako podłoża do hodowli komórek mięśnia sercowego”, E. Tomecka, M. Wojasiński, E. Jastrzębska, M. Chudy, T. Ciach, Z. Brzózka, XIII seminarium doktorantów "Na pograniczu Chemii i Biologii" 2015, 31.05 – 03.06.2015
20. „Mikrosystem przepływowy do przestrzennej hodowli komórek mięśnia sercowego”, E. Tomecka, K. Żukowski, E. Jastrzębska,, M. Chudy, Z. Brzózka, IX Polska Konferencja Chemii Analitycznej, 6-10.07.2015
21. „Ocena żywotności komórek mięśnia sercowego hodowanych w warunkach statycznych i przepływowych w systemach Lab-on-a-chip”, E. Tomecka, A. Kobuszewska, E. Jastrzębska, IX Polska Konferencja Chemii Analitycznej, 6-10.07.2015
22. “Nanofibrous mats as potential substrates for cardiac cell culture”, E. Tomecka, M. Wojasiński, E. Jastrzębska, M. Chudy, T. Ciach, 10th International Conference Young Scientist Towards the Challenges of Modern Technology 2015, 21-23.09.2015
23. “Proliferation of cardiac cells cultured under static and perfusion conditions” E. Jastrzębska, A. Kobuszewska, E. Tomecka, P. Renaud, Z. Brzózka, The 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2015, 25-29.10.2015
24. “Cardiac cell culture in microfluidic system with micropillar array” E. Tomecka, A. Kobuszewska, K. Żukowski, E. Jastrzębska, M. Chudy, A. Dybko, Z. Brzózka, The 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2015, 25-29.10.2015
25. „The use of nanofibrous mats for cardiac cell culture” E. Tomecka, M. Wojasiński, E. Jastrzębska, M. Chudy, T. Ciach, Z. Brzózka, 5th Annual Conference & Exhibition SLAS 2016, San Diego, USA, 23-27.01.2016
26. „Hodowla komórek mięśnia sercowego w mikrosystemie przepływowym”, E. Tomecka, K. Żukowski, E. Jastrzębska, M. Chudy, V Międzyuczelnianie Sympozjum Biotechnologiczne „Symbioza 2016”, Warszawa,22-24.04.2016
27. "Analysis of cardiac cell proliferation in microsystems Lab-on-a-Chip" A. Kobuszewska, E. Tomecka, E. Jastrzębska, Z. Brzózka, V Międzyuczelnianie Sympozjum Biotechnologiczne „Symbioza 2016”, Warszawa,22-24.04.2016
28. "Hodowla komórek mięśnia sercowego w mikrosystemie przepływowym" A. Kobuszewska, E. Tomecka, P. Ćwik, E. Jastrzębska, Z. Brzózka, Na Pograniczu Chemii i Biologii, Karpacz, 22-25.05.2016
29. „Mikrosystem przepływowy zintegrowany z nanowłóknami polimerowymi dedykowany hodowli komórek sercowych”, E. Tomecka, M. Wojasiński, E. Jastrzębska, M. Chudy, T. Ciach, Z. Brzózka, XIII Warszawskie Seminarium Doktorantów Chemików „ChemSession’16”, Warszawa,10.06.2016
30. "Badanie proliferacji komórek mięśnia sercowego (H9C2) w mikrosystemach przepływowych z wykorzystaniem spektroskopii impedancyjnej" A. Kobuszewska, P. Ćwik, E. Jastrzębska, Z. Brzózka, XIII Warszawskie Seminarium Doktorantów Chemików „ChemSession’16”, Warszawa,10.06.2016
31. „Microfluidic system for hydrogel-based 3D cardiac cell culture”, E. Tomecka, K. Żukowski, E. Jastrzębska, M. Chudy, Z. Brzózka, The 16thInternational Meeting on Chemical Sensors (IMCS2016), Jeju Island, Korea, 10-13.07.2016
32. "Heart-on-a-Chip - studies on cardiac (H9C2) cell proliferation using impedance spectroscopy" A. Kobuszewska, P. Świk, E. Jastrzębska, P. Renaud, Z. Brzózka, The 20th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2016, Dublin 9-13.10.2016
33. „Mikroprzepływowy model hodowli komórek mięśnia sercowego”, E. Tomecka –19. Międzynarodowe Targi Analityki i Technik Pomiarowych EuroLab, Warszawa, 29-31.03.201
34. “Microsystems for cell culture and nanoparticles analysis”, E. Jastrzebska, P. Sokolowska, E. Tomecka, A. Kobuszewska, K. Zukowski, M.Chudy, A. Dybko, Z. Brzozka, Frontier Forum on Nanoscience, Dubrovnik, 04-07.05.2017
35. „Symulacja niedotlenienia komórek mięśnia sercowego w mikrosystemach przepływowych” A. Kobuszewska, E. Jastrzębska, Z. Brzózka, XV Ogólnopolskie Seminarium Doktorantów "Na Pograniczu Chemii i Biologii" Karpacz, 21-24.05.2017
36. “Simulation of myocardial ischemia in Lab-on-a-Chip systems", A. Kobuszewska, E. Jastrzębska, Z. Brzózka, III International Conference of Cell Biology, Kraków, 26-27.05.2017
37. „Nanofiber mats fabricated by solution blow spinnig as potential substrates for cardiac cell culture” E. Tomecka, M. Wojasinski, E. Jastrzebska, M.Chudy T. Ciach T., Z. Brzozka, 5th Global Chemistry Congress, Londyn, 04-06.09.2017
38. “Cell model of myocardial hypoxia in lab-on-a-chip system” A. Kobuszewska, E. Jastrzębska, M. Chudy, A. Dybko, Z. Brzózka, The 21st International Conference on Miniaturized Systems for Chemistry and Life Science, Savannah, USA, 22-26.10.2017
39. “Microfluidic heart model for drug cytoxicity analysis” E.Tomecka, K. Zukowski, E. Jastrzębska, M. Chudy, Z. Brzózka, The 21st International Conference on Miniaturized Systems for Chemistry and Life Science, Savannah, USA, 22-26.10.2017
Prace magisterskie oraz inżynierskie:
1. „Badanie wpływu właściwości powierzchni hodowlanej na proliferację komórek mięśnia sercowego” – Praca inżynierka, inż. Zofia Nowakowska, POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 01.2015
2. „Opracowanie mikroukładu do prowadzenia hodowli komórek macierzystych.” – Praca inżynierka, inż. Edyta Dudek POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 01.2015
3. „Badanie proliferacji komórek mięśnia sercowego w mikrosystemach przepływowych” - Praca magisterska, mgr inż. Anna Kobuszewska, POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 06.2015
4. „Badanie ekspresji specyficznych markerów w komórkach mięśnia sercowego” – Praca inżynierska, inż. Aleksandra Pawłowska, POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 06.2016
5. „Ocena żywotności komórek serca w systemach typu Lab-on-a-chip” - – Praca magisterska, mgr inż. Marlena Gołębiewska, POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 06.2016
6. „Opracowanie systemu typu Lab-on-a-chip do symulacji choroby niedokrwiennej serca” - – Praca inżynierska, inż. Bogna Adamczyk, POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 01.2017
7. „Opracowanie metody oznaczania ekspresji specyficznych markerów w komórkach mięśnia sercowego w systemach typu Lab-on-a-chip” Praca magisterska, mgr inż. Patrycja Sokołowska, POLITECHNIKA WARSZAWSKA, WYDZIAŁ CHEMICZNY, Kierunek: BIOTECHNOLOGIA – 06.2017
Rozprawy doktorskie:
1. „Mikrosystemy przepływowe do badania modelu tkanki mięśnia sercowego” - mgr inż. Ewelina Tomecka – w trakcie przygotowania